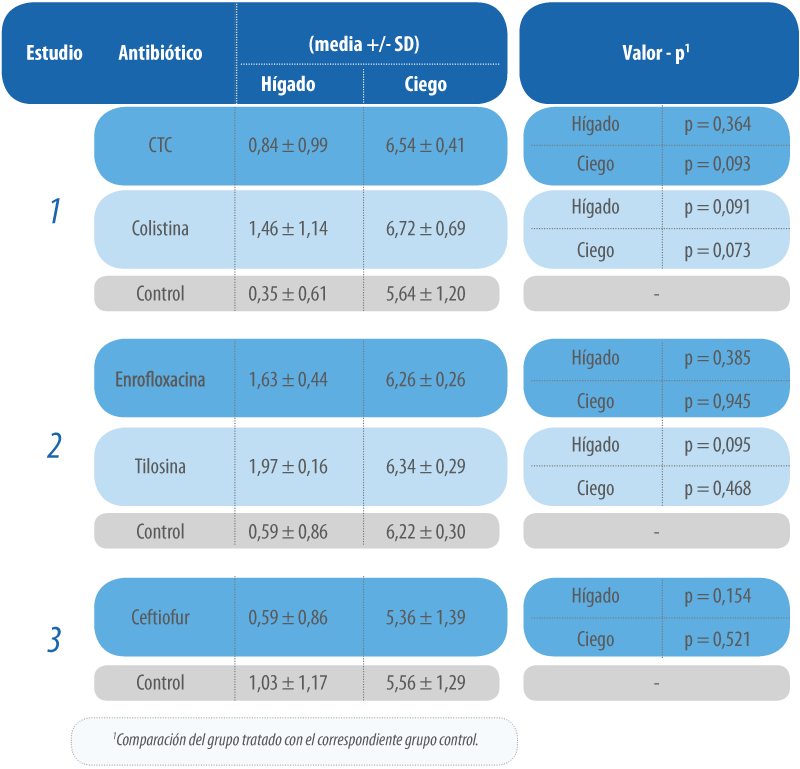
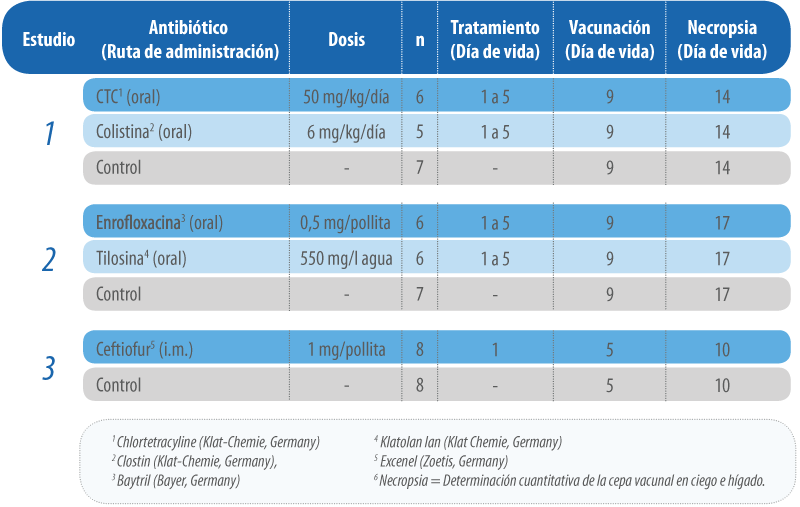
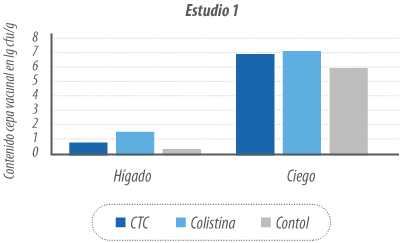
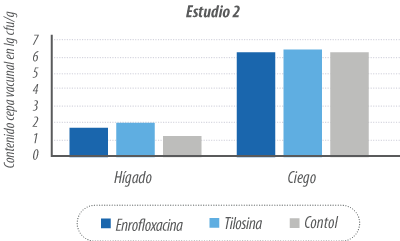
Incubadoras en tiempo de confinamiento
Parece que después de unos meses complicados empezamos a recuperar la normalidad o entramos en la “nueva normalidad”.
Desde Ceva nos ha parecido que es un buen momento para echar la vista atrás y analizar un poco como han afrontado este complicado período las 40 incubadoras con las que estamos en contacto el equipo Chick Program en nuestro país.
Desde hace años, los centros de incubación se han ido renovando para establecer medidas de bioseguridad muy estrictas a fin de evitar la entrada de contaminación del exterior.
Esto ha llevado a construir nuevas incubadoras con alto niveles de bioseguridad; alejadas de las granjas de reproductoras, intensificación de las barreras físicas y químicas alrededor de la incubadora (pediluvios, arcos de desafección, etc.).
Asimismo, se ha formado a los trabajadores para que sean conscientes de la importancia de la higiene y la bioseguridad dentro de la planta (ducha obligatoria antes de entrar, uso de mascarillas y guantes, etc). Desde el equipo de Ceva Salud Animal, durante más de 10 años, hemos estado al lado de todos ellos para colaborar en esta labor a través de nuestras visitas, formaciones y auditorías.
Gracias a estar habituados a trabajar con estrictas medidas de bioseguridad, sabemos que todas las incubadoras del país han podido seguir trabajando a pleno rendimiento durante el período de confinamiento.
Cabe destacar que los centros de incubación más automatizados, con equipos de vacunación in ovo, como el equipo Egginject®, les han resultado más fácil adaptarse a las nuevas normativas estatales, sobre todo a la de distanciamiento entre trabajadores.
En situaciones como la que hemos vivido queda claro que el trabajo bien hecho da sus frutos, por ello des de Ceva Salud Animal os agradecemos el trabajo realizado y os animamos a seguir con las buenas practicas empleadas en todos los centros de incubación!
Equipo C.H.I.C.K. program